
※この記事では、TBI=外傷性脳損傷 stroke=慢性機能梗塞 として表記しています。
サンバイオの機関投資家向け決算説明会動画が公開された。一昨日の脳梗塞復活IRで、昨日ストップ高終値1792円。本日2日連続のストップ高で終値2192円。2連続ストップ高でも、まあ何と安いことか。TBI上市への疑いの目や脳梗塞の失敗、コロナ禍もあってまさかの1500円辺りをさまよう切ない苦しみを乗り越えて、遂にサンバイオの大逆襲が始まった感がある。一昨日まで今回の決算は「TBI上市むけて(1月末までにできるかどうか。)の進捗具合を見る決算」のつもりだった。それが脳梗塞復活IRが出て大きく意味合いが変わった。以下、決算説明会動画を見て思ったこと色々。
【直近一番気になっているTBIの上市について】
森社長の、「かなりの手応えのある進捗を経てきております。」この一言を信じるしかない。3月の説明会で、「三度目の技術移転がこんなにも大変なものか・・・」と思ったが、その技術移転が「概ね完了」とのこと。よかった。3月には管理体制の中で特に「原材料管理」「品質保証」「分析体制」が課題とされていた。(下:3月説明会の資料)
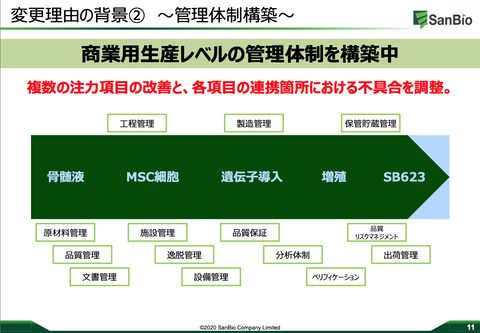
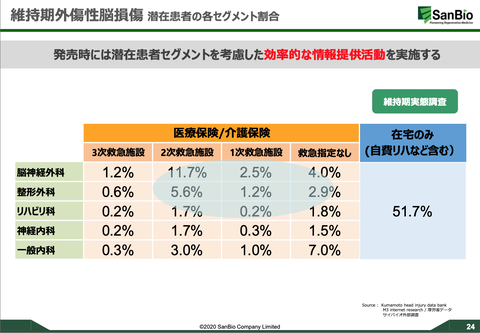
薬効そもそもを疑ってしまう「品質保証」が個人的に結構気にかかっていたが、その一番気にか買っていたことに対して「品質保証体制はかなり充実してきている。」との具体的説明が今回あった。これもよかった。規格試験の確立についても、前例のない再生細胞薬という新規産業特有の課題でしょうがないと認識していたが、「ロバストな堅牢性の高い方法の開発の最終段階」だとのこと。順調そうで安心する。発売準備は8割構築。R-SATシステムは完成。市場調査で患者様はどこに埋れているのかの把握もできている。多岐にわたる診療科の内のどこをターゲットにすればいいかも把握できている。(下写真参照)
脳梗塞復活話に華を持っていかれた感のある今回の決算説明会だったけれど、山本事業部長、地道ないい仕事をしていらっしゃる!この辺りの発売準備の進捗から言っても、仮に承認申請が再延期になったとしても近い将来の上市は既定路線だろう。SB623は先駆け指定を受けているので、PMDAとの「対面助言・事前面談」から「先駆け総合評価相談」へと駒を進めていることがわかれば上市角度も高まるのでこのことも知りたかったが話題には出ず。しかし、この質問は必ず機関投資家からされていると思うので、後日の質疑応答の要約文に期待したい。TBIの国内上市を本当に待ちわびたい。(脳梗塞復活の中に、TBI承認申請IRが出たら、市場はどういう反応をするのだろうか?えらいことになる。)
【慢性機能梗塞について】
なぜstrokep1/2aとTBIp2で効いて、strokep2bで効かない?訳わからない??という疑問がずっとあった。「そもそも細胞の問題?」「投与部位?」「患者の症状の程度や背景に差?」憶測は色々あったが、やっと解決。答えは「梗塞巣体積の問題」。つまり、やはりサンバイオが言っていた「患者の症状の程度や背景に差?」が正解。やはり会社の声明が一番正確だと改めて思う。今回の脳梗塞の追加解析結果を書面で見たときに、「再度解析のために『複合FMMSポイント』なるものを作り出し、無理やりに優位差有りに持って言ったのだろうか?ちょっと無理やりすぎないか?」と疑ってかかっていた。翌日ストップ高は理解できるも、市場は浮かれすぎてはないかと感じていた。しかし今日、統計学的優位差だけでなく、臨床的に意義のあることとは何なのか、MCID(患者における変化が有益であると解釈できる最小の変化値)(多数の専門家で導き出す意義のある概念)から「複合FMMSポイント」を導き出し、その尺度に基づいて再度解析をした結果優位差があったということがわかって、科学的エビデンスが成立していてとても素晴らしい・・・と絶句した。(ちなみに2019にnatureが「統計学的優位さに固執するのはやめようと言うコメントをオンライン公開している。)文句なしのストップ高事項。この「複合FMMSポイント」合計スコア9ポイント改善はまだしも、上肢6ポイント下肢4ポイントは若干低すぎる気もしていたが、「上肢66満点中の6点。来院時は30ぐらいで来る患者様が多いとしたら、その中の6ポイントは20%の向上にあたる」という説明は分かり易かった。6ポイント4ポイントというのは、臨床的に意味のある数字で意義がある。フェーズ2とは、そもそも探索的フェーズ。ビジャン医師が、意味があるstudyであったと強調していたが、色々な梗塞体積、色々な特性を有した患者様がいたフェーズ2の実施で、効果的な患者層を導き出せたことをフェーズ2の成功と言えるのではないだろうか。慢性期脳梗塞の全ての患者様のお役に立てないかもしれないことは今の時点では悔やまれるが、今も各大学で進めているTBI治験の投与部位解析が10月31日に終わる。この解析結果で的確な投与部位の精度が一層高められた場合、梗塞巣の大きさが一定以上の方にも効くと言うことが分かる可能性もあるのではないか。この解析結果も見守りたい。
3月の決算説明会で辻村専務(当時)が「脳梗塞・脳出血は、どの地域で開発することがベストなのか、様々なオプションを検討している最中です。」と述べた。「どの地域とは?」と謎が多かった。提携していた大日本住友製薬(strokeの未達公表後、「セカンダリエンドポイントは非常にたくさん置いている。」という大日の発言があったと思う。そのたくさんのエンドポイント解析では芳しい薬効を示せず大日本は離脱したのだろうと思う。ちなみに、サンバイオと大日本の契約解除は“両社合意”(←大日本IRに確認済み。)。今回は、これらの解析以外の道を模索しての見事復活だと思われる。そして大日本は提携を切った後も、2,820,511株をそのまま保有している。)大日本無き今、日本国内でコンパクトに開発を進めていくことには賛成する。
日本で確固とした製薬企業に脱皮することが、長期的に見ればグローバルリーダーになれる近道だろう。ただし、国内治験で進めた場合、民族差から海外治験を求められる可能性が高くなる(中国はその限りではない。中国は市場の大きさからどう進んでいくか期待大)。国内一本で開発を進めた場合、グローバル展開が遅くなるし、せっかくの米国RMAT指定(簡単に言うと米国の早期承認制度)も宝の持ち腐れになる。しかし、この新たな局面下では米国での新たなパートナー出現が期待できるのでないだろうか。念願のメガファーマが遂に登場だろうか。(←妄想)前回治験は、組み入れ完了から安全性の確認のために12カ月を置いている。しかし安全性はすでにわかっているので、次回治験は6カ月でいけると思われる。この短縮は、ありがたい。慢性期脳梗塞の今後の進捗には大きく期待したい。
脳出血適応の話が今回は大きくならなかったが、確か記憶では、脳梗塞と脳損傷の病理は非常に似ていて、この2つで行けたのなら脳出血で行けないはずがない的なお医者様のコメントを過去に読んだ気がする。脳出血についても朗報を待ちたい。
2年前に森社長と川西会長がたってのお願いで入社した辻村専務が副社長へ昇格。
辻村副社長→オペレーションの統括
森社長→2025グローバルリーダーを見据えての活動
をしていくとのこと。新体制で、ぜひ今後も邁進して言ってほしい。森社長は、stroke失敗後「もちろん、私は慢性期脳梗塞における開発を諦めたわけではございません。」を直後に表明した。この思いを有言実行したのは見事だ。そして、「2020製薬企業へ脱皮する」は、昨年社内の反対もあったけれど社長は言い切った。タイムラグはあるけれど、会社はそちらの方向に向かっていて、言い切った社長の男気を感じる。今回の説明会の最後は「日本発、再生医療分野のグローバルリーダーへ」の話で閉じられた。先日の株価1500円割れは悲しかった。「なぜ夢のある、頑張っている企業がここまで評価されないのか」悶々としていた。この評価が今一変している。こんなにうれしいことはない。挫折や失敗は人間を強くする。サンバイオも強くなったのではないだろうか。がんばれサンバイオ!夢の再生細胞薬が人類を救うのはもう間近!

コメント
コメント一覧 (9)
bobouchan
が しました
しました
bobouchan
が しました
しました
直近TBI承認申請が爆発的躍進のスタートになると思います。
bobouchan
が しました
しました
それを踏まえて、ブログを拝読いたしますと、私の頭の中にあることを、とても明快に鋭くご指摘されています。とうことで、追加の「応援する掲示板」投稿は止めました。
一番感じることは、パートナーが何と言おうと、投資家が何と言おうと、サンバイオの決してあきらめない強い意志です。エーザイが、アルツハイマー新薬開発で、有意差がないこともあったけれども、それでも開発を続けた、それと似ています。諦めない、継続は力なりということでしょうね。
TBIのグローバルフェーズ3が来年以降になったことは、ご推察の通りと思います。
1)人的資源、資金に制約があり、自己開発は国内2治験なら手元資金で十分可能。
2)TBIのグローバル治験をやるなら、さらに100億円程度資金が必要なはず。従って、メガファーマとのアライアンス、ファイナンスの複合対応をすると予想しています。辻村、ホラン執行役員いずれもそういう経験が豊富です。
多分、国内2治験で企業価値を最大級に高めた上で、後者の道を選択すると予想しています。
bobouchan
が しました
しました
bobouchan
が しました
しました
SB623の価値を最大化するという目的の一つにはより良い条件で契約するってことがあると思うんです。やはり国内承認が出る前と出た後とでは交渉できる条件が大きく変わってくるでしょうから。なので個人的には提携の話は少なくとも承認後にしか出てこないのでは予想します。
※個人的な妄想です
bobouchan
が しました
しました
2度あることは3度あるのか、またやらかすのか。
失った、信用回復するのは大変です。
bobouchan
が しました
しました
日本をとっかかりにすることとアメリカを巻き込むこと。この二つさえクリア出来れば後は時間の問題だと思います。
色々不安はありますが信じて待つしかないと皆様の書き込みを見て思いました。年単位であればきっと結果を残してくれると。
念ずれば花開く。関係者様のほとんどの人生をかけた集大成を拝見します。
日本の次はグローバルと言わずアメリカだけに集中して欲しいですね。カリフォルニアから補助金貰ってるメリットを風化させないで欲しいです。アメリカは自国に有利なことには興味深く熱心ですが見切りも早い気がします。駄文失礼しました。ブログいつも楽しみにしてます。ありがとうございますm(_ _)m
bobouchan
が しました
しました