サンバイオのSB623が外傷性脳損傷における後遺症の改善を効能として「希少疾病用再生医療等製品」(いわゆるオーファンフォラッグ)に指定された。6月16日に日刊薬業でスクープされ、翌日厚労省HPに議事録が上がり、25日に正式決定と思っていたが、本日24日に1日早くサンバイオからIRが出た。(明日、厚労省から何かしらの告示があるのだろうか?)(「後遺症」と言う表記は初めてではないか?上市に向けて表記の確度を高めているのだろうか?)
希少疾病用医薬品・医療機器 (オーファンドラッグ・デバイス)の指定では以下のメリットを享受できる。
①優先的な治験相談及び優先審査の実施
総審査期間 新医薬品9ヵ月(通常品目は12ヵ月)
→先駆け審査指定制度(SB623は、2019年4月8日に指定)と合わせて、厚労省もPMDAも、優先、優先、で進んでいくことになる。
②申請手数料の減額
→再生医療等製品は、新規承認を取るだけで2000万円強の手数料がかかる。どれぐらいの減額かはわからないけれど、バイオベンチャーにとっては馬鹿にできない額だろうか。
③再審査期間の延長
通常8年を10年に延長。この間後発品は、承認申請の際に、新薬同様の資料を求められる。(→その結果、この期間は新薬等の開発企業のみが市場供給を行う場合が多い)
→競合他社を寄せ付けず、ブルーオーシャンを謳歌できる。
④試験研究費への助成金交付
指定から承認申請までに必要な試験研究に要する直接経費の2分の1に相当する額を上限。
→投資家が嫌う増資懸念の軽減に寄与。ただ、フェーズ2終わって、申請間近のSB623にとってどこまでこの助成金を発生するか?条件付き早期承認制度での上市になった場合、上市しながらのデータ収集が求められるので、そこへの助成金になると言うことだろうか?
⑤税制措置上の優遇措置
助成金を除くオーファンドラッグ等の試験研究費総額の12%が税控除の対象。
→「試験研究費」がどこまでを指すのか。工場ライン整備などにも含まれるのか?「日立化成」改め「昭和電工マテリアルズ」の製造分野などにも控除が効くのか?いずれにせよ、税控除は、バイオベンチャーにとってはありがたい。
様々な実利的メリットを享受できる。TBI申請において今まで寝耳に水な指定であったけれど、メリット大であるから喜ばしい。めでたい。
厚労省HPの中でUPされた以下の議事録要旨も興味深い。記録として、ここにも残しておこうと思う。
「令和2年度第1回 再生医療等製品・生物由来技術部会議事要旨」
楠岡委員の指摘で、STR02試験(SB623を使った、慢性期脳梗塞適応の治験。主要評価項目未達だった。)の結果を出させていることが若干気になる。この試験結果がTBIに良い影響をもたらすことを願う。悪い影響を及ぼす可能性があるのかないのか、「一剤多適応」のオーファン前例が見当たらずわからない。
森尾委員の「より大規模データにて検証すべき点と思われます。」は、「条件付き早期承認」を指しているのか、フェーズ3の実施を示唆しているのか、この文面からは読めないが、先駆け審査指定を受けていることから、前者と思われ、上市確率が飛躍的に高まった点で今回のオーファン指定は意義深い。
何より心強いのは、オーファン指定を受けた医薬品の高い承認実績にある。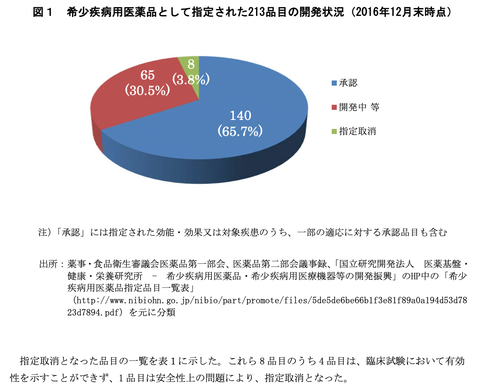
http://www.jpma.or.jp/opir/research/rs_070/paper_70.pdfより。
2016年時点で、65%以上の承認実績がある。
ちなみに先駆け指定も、再生医療等製品で13品目申請があったうちの2件(オンコリスバイオファーマとサンバイオ )に選ばれているので、決して広くはない門をくぐり抜けてきている。SB623は米国RMAT指定含めて多様な指定を受けることに成功している。
結局、オーファン指定が取れた=上市確率が高まった。と言うことで非常に喜ばしい。22時現在PTSがそれなりに反応しているのも納得がいく。
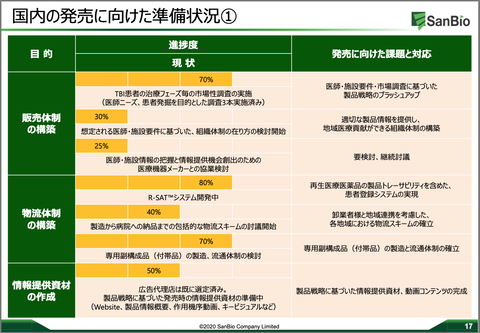
今年3月18日の決算説明会で示された以下の資料。
あれから3ヶ月が経過し、それなりに進捗していると思う。さらに3ヶ月後の9月の決算説明会で、この表がどれくらい進んでいるのか、それをもって会社が掲げている2021年1月期(つまり2021年1月末日まで)に申請ができるかがほぼ判明できる・判断できると思っている。
TBI国内上市は、「患者数たった2100人?」とかそう言うスケールの小さな話ではない。
まず、SB623は米国RMAT指定を受けているので、日本上市を持って、巨大マーケットの米国がどう判断していくのか見もの。RMAT指定が威力を発揮し出すのも近い。
さらに、人種の差がないと考えられ、日本国内の申請資料&日本国内の販売後データのみで申請が認められ、米国と違って皆保険制度が最近整えられた中国がどう動くのかもさらに見もの。眼科疾患でとはいえ、3月に業務提携した中華企業Ocumensionがどう動いていくのか非常に楽しみ。(Ocumension以外の中華企業の参画も十分あり得る。)
さらに、「世界初の再生細胞薬」の上市は、流通・管理体制の構築も大変で、このノウハウを完成させているサンバイオは世界でも無双。米国・中国でのこの体制構築にどれぐらいの時間を要するのか気がかりであることは事実ではあるけれど、それこそ巨大メガファーマと進めていく?サンバイオの野心通り、米国もあくまで自販にこだわっていく?どちらにせよ、将来性が非常に興味深い会社である。
期待されていた慢性期脳梗塞適応での開発が遅れを見せているが、TBIでの上市を無事に果たし、他適応での開発を加速度的に進めていくことを願わずにはいられないし、いよいよ(数度待ちぼうけを食らいながら!)という感じがしてくる今回のオーファン指定だった。
つまづきもあるが、夢のある進捗が多数あるのも事実。夢の新薬上市へ!がんばれ!サンバイオ !






コメント
コメント一覧 (17)
ようやく会社からIRが出ましたね。しかし、記事にはとっくに出ていたので株価は大して反応しないと踏んでましたがPTSは反応してますね。記事と正式発表でこんなに変わるとは株って難しい。今日追加しておいて良かったです。
これを機に申請・承認の確度が大きく上がったとみてよいですね。
粛々と製造の問題を解決し、年内申請を目指して欲しいですね。
助成金について厚労省のHPでは見つけられない点を、国立研究開発法人のHPで見つけました。「助成金交付を受けて製造販売承認の取得に至った場合、売上高の一部を納付いただき、本事業に充てています。」とのことなので、売上が発生すると、助成金は返さないといけない仕組みみたいです。
それが全部なのか一部でよいかまでは分かりませんでした。
bobouchan
が しました
しました
bobouchan
が しました
しました
国立開発法人HPの情報ありがとうございます!(応援掲示板への「助成対象経費」のご投稿も勉強になりました!)申請IRへの手応えをみんなが感じていると思います。がんばれ!サンバイオ !
電池ヌキヌキさん
そうおっしゃらずに、長期保有も夢がありますよ!
bobouchan
が しました
しました
bobouchan
が しました
しました
サンバイオみたいに、長らくドボンしている銘柄でも、結構楽しみ方はあり、勉強にもなります。
縁あって、長期保有している銘柄の研究で、結構バイオの知識が深められます。洞察力の養成にもなります。サンバイオのおかげで、医療全般については、数年前に比べ格段理解が深まり、その分楽しめています。
ポイントは、SB623の価値をどう評価できるか、できないか、です。そこは、あくまで自己責任で判断すべきです。額に汗する必要があります。評価できないなら、即刻売却で良いでしょう。
それでも、報われなかったら?その可能性もあります。でも、致命傷にならない範囲で続ければ良いということだと、個人的には思います。
逆サンバイオショック(ポジティブ・サプライズ)の妄想も楽しからずや、です。
bobouchan
が しました
しました
国内TBIだけでもこれから上げるタイミングは下記4回はあると思ってます。4は米国での学会発表をメディアが取り上げたのがそうでしたね。
1.承認申請完了後、急騰→調整。
2.承認時期が近づくにつれ、徐々に上げ。
3.承認取得後、急騰→調整。
4.各メディアが取り上げ、急騰→調整。
でもあれもこれも全ては承認申請がなされなければ全ては絵空事です。
申請準備に関してはコロナの影響は大方なくなってきたはず。約束通り年内の申請に注力してもらうと同時に、グローバルP3、脳梗塞の追加治験、脳出血もスピード感もって進行させて欲しい。
bobouchan
が しました
しました
・TBIの米国(RMAT指定)と中国(日本の治験で代替)マーケットがどうなるか。
・脳出血はP3スタートだと思う。
・脳出血が成功したらものすごいし、その頃には脳梗塞の投与箇所研究が進み、脳梗塞上市
も視野に。
など。
「ポテンシャル」の話です。
僕は、TBI日本上市では投資スタンスは揺らぐことなく、2025を視点に保有していく考えです。
SB623は「何か」を秘めている。
bobouchan
が しました
しました
bobouchan
が しました
しました
bobouchan
が しました
しました
bobouchan
が しました
しました
bobouchan
が しました
しました
2020年7月10日
bobouchan
が しました
しました
「短期の株主さんには報えない覚悟はできています!」と言い切られたことがあります。
賛否両論、反論もできる様な発言ではありますが、社長として長期展望をもって会社運営してるいんだという覚悟は伝わってきました。
短期の株価に一喜一憂するような小さな器では社長は務まらないと思うし、ベンチャーでは尚更ではないでしょうか。
bobouchan
が しました
しました