SB623の申請が年内に行われないかも知れない可能性を危惧して今日の終値947円。
今日の決算跨ぎを嫌うムードもあっただろう。
しかしまさかの3桁。
切ないが、ここからのV字回復を、自分はなぜか心静かに期待していた。それは、幾年もサンバイオを見てきたからの境地からだろうか。
決して詐欺を働いたり、人を馬鹿にしたりする会社ではない。
お粗末な姿勢もあったことは否めないが、愚直に誠実に製薬に取り組んでいる真面目な会社であると自分は評価している。だから長期ホールドを決めて、短期の株価変動では一喜一憂しない。
そんな中、決算発表が今日あった。そしていくつかのIRも同時にあった。両者、期待が持てるものだった。相変わらず、愚直に誠実に製薬に取り組んでいる。それで十分。心穏やかに年末年始を迎えられる。サンバイオ社員の皆さまお疲れ様です。
多くの方の心を掴んだのは、決算短信の中に組み込まれたこの一文だろうと思う。
「SB623慢性期外傷性脳損傷プログラムは、現在、この『先駆け総合評価相談』のフェーズにいます。」
頑なに、機関投資家向け説明会でも、株主総会でも、「当局関連なので非開示です。」を繰り返し、口を閉じてきたことを、ついに表明した。
このことは、
A;入ったから「入った」と言ったのか
B;入っていたけど「入った」と言えずに、今「入った」と言えるようになったのか。
のどちらだろうか。
恐らくBパターンだと思う
「先駆け総合評価相談」は「品質」「非臨床」「臨床」「信頼性」「GTCP」の5区分からなっている。最初の区分の資料提出から最後の区分の申請確認文書の伝達までは、PMDAによると4ヶ月程度が目安となっている(下図参照)。ただ、この「4ヶ月」は、他社事例を見ていると必ずしも守られていない。大幅に伸びている事例もある。こういう背景から考えるに、今なら「入ったと言ってOKだよ。」とPMDAのお許しが出たのだろう。そうすると、いよいよ4ヶ月以内に申請できる目処が立ったと見るのが妥当だと思う。ざっくり今年度中の申請確度は、抜群に高いと思う。よく表明してくださっと思う。この辺りは、株主コミュニケーションを理解してくださってのことだと評価したい。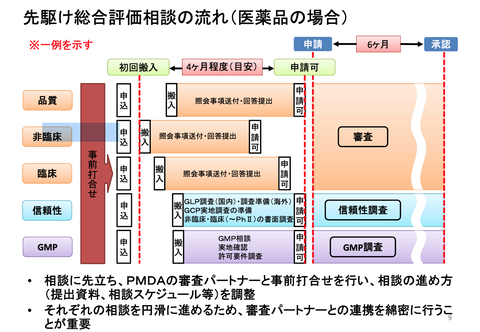
https://www.mhlw.go.jp/file/05-Shingikai-11121000-Iyakushokuhinkyoku-Soumuka/0000123357.pdf
2021年4月の株主総会で森社長が以下の発言をしている。
“当局関連の事項が多いので非開示になる。「以前のサンバイオならもっと色々踏み込んで開示したのでは?」そういう声・そういう側面もある。数年前までは、研究開発型ベンチャー企業ということで、積極的に開示するということをしていたが、だんだん、申請・上市・販売が近づくと、製薬企業としての開示姿勢・開示方針が求められる中で、今そこに相応しい開示方針をとったという背景がある。「開示方針変わったな」と思われる方がいると思うが、会社が成長する中で試行錯誤する中で、とるべき開示方針をとっている。皆さんのご懸念はごもっともだと思うが、こういうステージにあるのでご理解していただければありがたい。最初の遅延発表後、3つの課題、安定供給の課題を説明した経緯がある。書類の作成・整備・当局との数回というのではないたくさんの話し合いがある。先駆け総合評価相談に入っているかどうかも、当局関連なので非開示になる。また、事業提携、引き続き色々な話はありますし、随時、検討している。”
こうした発言も過去あった上での今回の「『先駆け総合評価相談』のフェーズにいます。」発言は重大。PTSが張り付くことも理解できる。
また、自分は、全米外傷性脳損傷レジストリ協会(National TBI Registry Coalition、以下「NTRC」設立IRは、大分良IRだと思っている。山本さん(以前の本ブログ記事「サンバイオ元事業部長 山本さんの講演を聞いた。」参照→ http://bouchan.info/archives/30040354.html)も噛んでいるのかな?とふと思ったりする。米国市場での上市が射程圏内にグッと近づく良IR。
米国関連の大きな動きとしては、2019年の以下の2点があった。
・米国国防総省開催のシンポジウム(Military Health System Research Symposium 2019)でTBIフェーズ2の結果発表。
・SB623が、米国食品医薬品局(FDA)よりRMAT指定(※TBI適応)。いわば、米国版迅速承認制度。
周知の通り、国内TBI市場はそんなに大きくない。本命は米国市場。日本国内上市の実績を持って、米国メガファーマとの協働も今後可能性はある。特にRMAT指定は、素晴らしい制度である。
RMAT指定による優遇措置には以下の3つがある。
A:FDA(アメリカ食品医薬品局)に製品開発及び審査を促進しうるサポートを受けることが出来る。
B:優先審査制度
C:迅速承認制度
AはFDAによる審査において、開発初期から助言が得られる。
Bは10ヶ月の審査が、6か月以内に短縮される。
Cは標準的試験のかわりにサロゲート(代用)または中間エンドポイントでの結果から販売承認を行うことが出来る。つまり、手続きのスキップであり、代わりに発売後の第4相試験が必要。(やはり第3相はかなりの形で省略か?)Bのみを取り上げて、10ヶ月が6ヶ月になっただけ・・・という論調もあるようだけれど、そうじゃなく、A~C3つの特典があって意義の大きい指定である。日本国内申請の実績を持って、米国RMAT指定での米国承認となれば、相当なことになる。こういう夢も抱きたい。
ちなみに、アメリカTBIの潜在患者数で将来のサンバイオの株価を遊びで計算すると以下のようになる。(※遊びの計算です。)
____________________________________________________________
TBIはアメリカでの患者数が多く、今日のIRでは
「317 万人が外傷性脳損傷に続発する運動障害を長期に抱えて生活していると推定されています。」とある。
仮に317万人の5%の患者さんに投与したとして、317万人×5%=約16万人。
仮に薬価300万円として300万円×16万人=約4800億円。
低く見積もってこの3割がサンバイオの純利益だとして、4800億円×0.3=約1440億円。
1440億円を、サンバイオの発行済株式数約5000万で割ると、EPS(一株益)は2880円。
東証一部の医薬品業の平均PERが大体30ぐらいなので、2880×30=86400
株価86400円
___________________________________________________________
毎年毎年5%の患者さんに投与を続けるというわけにはいかないだろうけれど、結構保守的に見ても中々夢がある数字が出てくる。一時マザーズを牽引したサンバイオのパワーとはこういうところにある。
加えて、今日のコミットメントラインのお相手は、「りそな銀行」。今まで、「みずほ銀行」「三菱 UFJ銀行」「三井住友銀行」はお付き合いがあったけど、りそな銀行は新規パートナー。銀行業界6位の大手。このことも良IRだったと思う。
様々な良報告が盛り込まれた今回の決算。相変わらず、サンバイオは着々と進展している。この調子でがんばれサンバイオ!!

