TBIの申請にこぎつけられてほっとしております。今までは申請に向けて当局の刺激を避けるためにも、あまり積極的な発信は控えてきたと言うところであったと思うんですけれども、申請を受けてと言う所もあると思いますので、今後のメディアあるいはマスコミ等への戦略と言うんでしょうか、露出とか広告、そうした面と言うのはどういうふうな形になっていくのか、見通しを教えてください。もう一つ、せっかくの総会という機会ですので川西会長の方からも一言ぜひ、見通しとコメントをぜひいただけたらと思います。お願いします。
A6
(森社長)
1問目に付きましては辻村より、そして2問目に付きましては川西よりですね、ご回答したいと思います。
(辻村副社長)
副社長の辻村です。今後のメディア対策と言うかですが、今もですね申請はしているんですけれどもまだ正確に承認されていると言うものではないので、まだ製品に関してのプロモーションはできない状況でございます。いろんな形でこれからメディアにも取り上げられていくとは思いますので、その時点でですね、お話しできる事は積極的にお話ししていきたいという対応は変えないでやっていきたいと思っておりますし、我々が今回ターゲットにしているというか、患者さんは慢性期の患者さんが非常に多くございまして、慢性期の患者さんは、治療ももう終わってまして、後はリハビリについてももう終わっている患者さんがほとんどで、どちらかと言うとご自宅にいらっしゃったり、リハビリ施設に通わられたりする患者さんが多いというふうに認識ております。ですからそういう患者さんに対してですね、幅広くサンバイオのことをわかっていただくための、そういう意味のですね、メディアに対するアプローチと言うのは、これから積極的に考えていかなければならないなと言うふうには考えています。以上ご回答申し上げました。
(森社長)
今話がありましたように、なかなか規制等もありですね、そういったところはしっかりと考えながら、ただより多くの患者さんに知っていただきたいといったところです。直接のメディア戦略でのご回答になるかどうかわからないのですが、今上市準備をしておりまして、皆さんご存知かと思いますけども、その中でですね、このような形で準備をしていますと言うのがありますので、そういったところを皆様にごく簡単にでも知っていただくと、いろいろなところでですね、皆様からもお話しいただけると思いますので、それでは簡単にですけれども束原より、ごく手短にですがご紹介させていただいて、皆様からも情報発信をいただけるのかと。
(束原事業本部長)
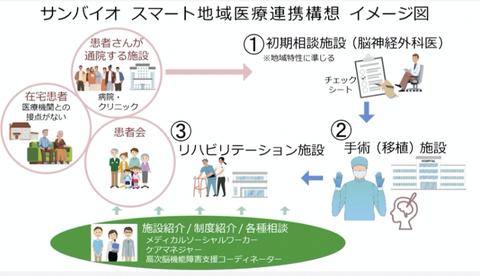
はじめまして執行役員日本アジア事業本部長の束原と申します。スライドの方をお願いできますでしょうか。こちらの方ですね、我々の方上市の準備と言うことで、こちらあくまでも承認を受けて薬価が収載されて、発売できる状況になってからの話になりますけれども、現時点で我々の考えているどのような形で患者様にこのお薬をお届けするのかと言った所の構想になっております。先ほど辻村の方からお話もありました通り、TBIの患者様はほとんど慢性期と言うことで、必ずしも病院に通っていらっしゃらない場合もあると、そういった形で在宅でいらっしゃる患者さん、あるいはTBIと直接関係なく近隣のクリニックに通われている患者様が比較的多いんではないのかなと考えております。そのような患者様がですね、今後何らかの形で治療したいと言った場合には、まずはですね、脳神経外科の先生方に紹介をいただきまして、そこのところでですね実際このSB623が適用になるかと言うことをざっくりとですね判断いただきまして、その後手術を実際に行う施設に紹介いただくと、こちらのこの手術の施設と言うものに関しましてはですね、それなりの細胞を実際調整してですね、手術ができると言う施設が必要でございますので、大体大学病院あるいはそれに準ずるような大きな施設と言うことで各日本の各地域で、中核都市にある施設と言うところに紹介をいただくと、そこで改めて判断をしていただいて投与すると、その後ですねやはりこの薬を投与しただけでは不十分になるかと思いますので、その後しっかりとリハビリテーションを行っていただくと、こういったですね、地域連携のシステムというの考えております。こちらのこういったシステムに関してですね、実際にでは患者様にどう(~通信環境が乱れ10秒程度聞き取れず~)ケアマネージャーの方あるいは高次機能障害の支援のコーディネーターの方、こういった方に患者様に対しての情報提供をお願いすると言うことになろうかと思います。こういった関連するいわゆるメディカルの方々にですね、情報提供と言うのを今後我々弊社のウェブサイトあるいはコールセンターあるいはその他のですね活動を通じてやっていきたいなと言うふうに考えております。こちらのほうはまだ構想段階でございますけれども、承認後しっかりと私どもの方で実施する体制を作っていきたいなというふうに考えております。以上ちょっと簡単にご説明させていただきました。
(川西会長)
代表取締役会長の川西でございます。ご指名いただきましてありがとうございます。株主の皆様本当に日ごろから応援ご支援いただいて感謝しております。先ほどもご質問の中で申請完了と言うことで激励の言葉を多々いただきまして、本当に感激しております。やはり森と2001年に会社設立立ち上げまして、この20数年間本当に会社の存続危ぶまれるようなですね、特に資金繰りに関わることが多かったですけれども、そのたびに脳機能を改善すると言う薬の開発、これを賛同いただいて、お力添えを得ることによって乗り越えてきたという経緯がございますので、本当に心から株主の皆様感謝しております。先ほど冒頭にもありましたけれども、本日時点で37,000人を超える株主の方々にご支援いただいていると思うと、本当にあの身が引き締まる思いでありますし、おかげさまで承認申請何とかやりきることができました。この過程ではですね、先ほどからご回答申し上げておりますけれども、そちらの辻村が陣頭指揮をとってやってきましたし、森も特に生産周りに関しては最前線で腕を振るってですね、社員たちもそれについてきていただいて、年末年始それから週末もなく本当に献身的にやっていただいてここまで来れたと言う事かと思います。 社員だけではなくですね、協力会社の皆さんとか、規制当局の担当のチームの方々なんかも本当に力強い後押しをしていただいて、ここまで来たと。本当ににこのSB623と言う新しい領域を作る再生細胞薬と言うものを、関わっている皆さんが本当に熱い思いを持ってやっていただいているんだなと言うことをひしひしと感じております。株主の皆様にも言えることだと思うんですけども、そういった意味では、これをですね、しっかりと患者さんの下にできるだけ早く届け、それから苦しんでいる患者さんは世界中にいらっしゃいます。ですからできるだけ早く日本だけではなくて、海外にも普及し、それでもって再生細胞薬と言う新しい領域を切り開いてグローバルリーダーになると、これ本気でずっと取り組み続けておりますので、こういったことを持って昨今の株主の方にすると株価は気になるところかもしれませんが、公開価格を下回ると言う非常に低い水準で、ここに関しては非常に申し訳なく思っておりますけれども、今言ったようなこの製品のポテンシャルを最大限に発揮することができれば、そういった部分でも株主の皆様にしっかりと恩返しができるのかなと思っております。今後とも全社一丸となって取り組んでまいりますので引き続き応援をよろしくお願いいたします。以上回答申し上げました。
Q7
今のことに関連いたしまして、資金調達についてご質問をさせていただきたいと思います。私も一株主として目先の大きな山場を越えて承認申請に断ったことで、大きな不安が1つ取れて安心しています。ただまだ先は長くて、多くのハードルは越えていかなければと思いますので、そんなに楽観はしていません。資金調達に関しても当然時間がかかればかかるほどお金も必要になってくると思いますし、今回のワラントに関しても市場での消化にてこずっていて、それのせいといいますか株価も冴えない動きだっていうのは想定していたことなんですけれども、これも時期が来ればいずれ株価も低迷は脱すると言うふうに思ってますし、経営陣の方は我々お金だけ出している株主と違って、人生全て捧げておりますので頭の下がる思いです。今回、資金調達について借り入れと市場からの調達、あと補助金に加えて、「その他」っていうのが目にしたんですけれど、「その他」っていうのは具体的にどういうようなことを考えておられるのか、もし差し支えなければ教えていただきたいと思います。よろしくお願いします。
A7
(角谷経営管理部長)
執行役員経営管理部長の角谷です。私の方からご回答させていただきます。まずどこからお話しすればっていうところなんですけれども、手元の資金需要というか資金調達ですね、その資金残高ですね、これについて少し触れさせてください。まずは期首の残高が銀行借り入れも含めて45億円、それと未使用のコミットメント枠ですね、これ銀行さんとの締結になるんですが、我々が使いたいときにドローダウンして使えると言う残高が53億円あります。またちょっと今てこずっていると言う話で、まさにその通りなんですけれども、エクイティファイナンスで今これが完了すると大体今の株価水準ですと70億円から80億円位が調達と言うことになりますので、これら合わせますと170億円から180億円位というのが当面の我々の資金と言う事ですので、当面この資金を使って事業を回していくと言うことになります。加えまして、これ以外の資金調達ですね、ご質問にあったところなんですが、まさにあのTBIの承認申請がされたと言うことで非常に事業の価値ひいては企業価値ですね、これが上がっていると言う所ですので、これらを活用しまして1つはライセンスアウトと言うのも重要な資金調達手段だと思いますし、先程ご質問いただいていた補助金ですかね、補助金なんかもうまく活用していくと言うところがプラスの資金調達手段だと言うことになりますので、これら含めて今の手元の資金に加えて資金調達今やってるのも加えて、総合的に今後事業回していくと言う中で多角的に資金調達を考えていきたいと言うふうに考えています。以上ご回答申し上げました
(森社長)
今角谷よりお話がありましたように、製品の価値としては今回は申請これから承認に向かいますが、これによって確固たる基盤を作ってきていますので、ファンダメンタルズとしては、価値としては良いものになってきていると、高まっていると信じておりますので、そういった意味ではパートナリングや今話がありましたがそういったところもですね、以前よりもより良い形に持っていけるのかなと思っておりまして、事業を加速する上では積極的に取り組んでいこうと考えております。以上補足でした。
続く。